肽
天然存在的肽分子有些是蛋白质降解的片段,有些是具有特殊的生理和药理作用的活性物质。
多肽,多数是开链肽,少数为分支开链肽,环状的多肽则比较少见。
肽与氨基酸一样以偶极离子形式存在,具有各自的等电点。在水溶液中的酸碱性质,主要取决于侧链可解离的R基团的数目和性质。
肽也能发生类似于氨基酸所发生的脱羧反应、与亚硝酸反应和酰化反应等,肽也能发生氨基酸的呈色反应。
但多肽是由多个氨基酸残基连接而成,它的性质和功能与氨基酸又有明显差异。如三肽以上的多肽能发生缩二脲反应,而氨基酸则无此现象。因此,缩二脲反应被广泛用于肽和蛋白质的定性分析和定量分析。
一、结构和命名
肽是氨基酸之间通过酰胺键相连而成的一类化合物,肽分子中的酰胺键又称为肽键(peptide bond)。氨基酸形成肽后,已不是完整的氨基酸,故将肽中的氨基酸单位称为氨基酸残基(amino acid residue)。
二肽可视为一分子氨基酸中的-COO-(一般为α-COO-)与另一分子氨基酸中的-NH3+(一般为α-NH3+)脱水缩合而成。肽也以两性离子的形式存在。
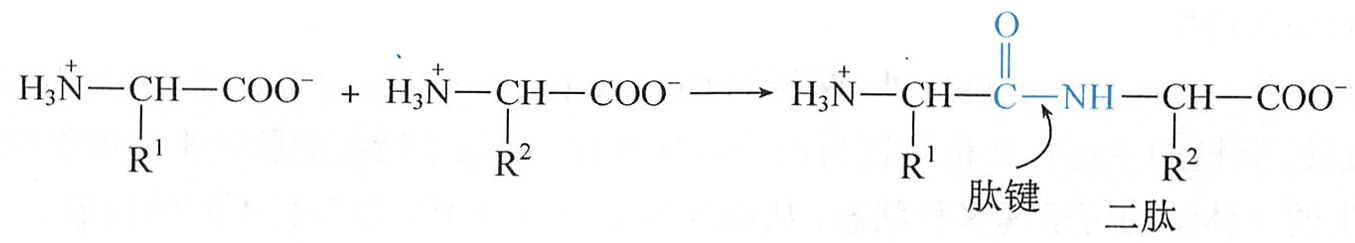
二肽分子的两端仍存在游离的-NH3+和-COO-,因此它可以再与另一分子氨基酸脱水缩合形成三肽;同样依次可形成四肽、五肽……十肽以下的称为寡肽(oligopeptide),大于十肽的称为多肽(polypeptide)。
虽然存在环肽,但绝大多数的肽呈链状,称为多肽链,一般可用通式表示:
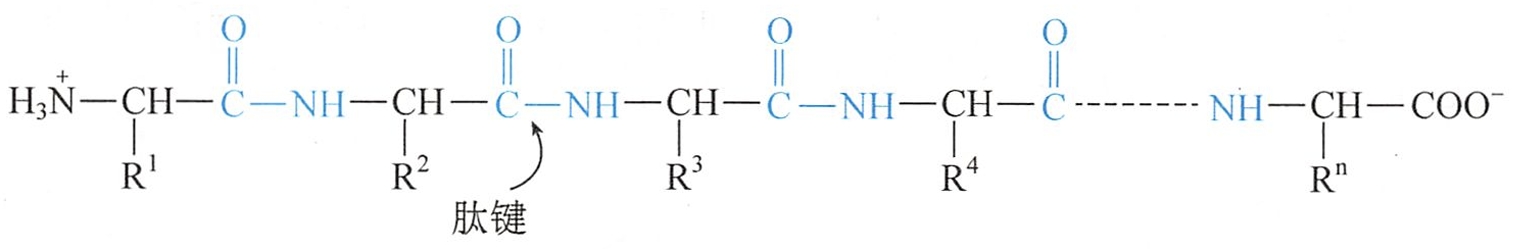
在肽链的一端仍保留着游离的-NH3+,称为氨基末端或N-端;而另一端则保留着游离的-COO-,称为羧基末端或C-端。
肽的结构不仅取决于组成肽链的氨基酸种类和数目,而且也与肽链中各氨基酸残基的排列顺序有关。
由两种不同的氨基酸(如甘氨酸和丙氨酸)组成二肽时,因连接顺序差异,可形成两种异构体:一种为丙氨酸的-NH3+和甘氨酸的-COO-脱水缩合而成;另一种为甘氨酸的-NH3+和丙氨酸的-COO-脱水缩合而成。肽的命名通常以含C-端的氨基酸为母体称为某氨酸,而肽链中其他的氨基酸残基从N-端开始依次称某氨酰,置于母体名称之前。也可用英文表示。例如由丙氨酸和甘氨酸可构成以下两种肽:
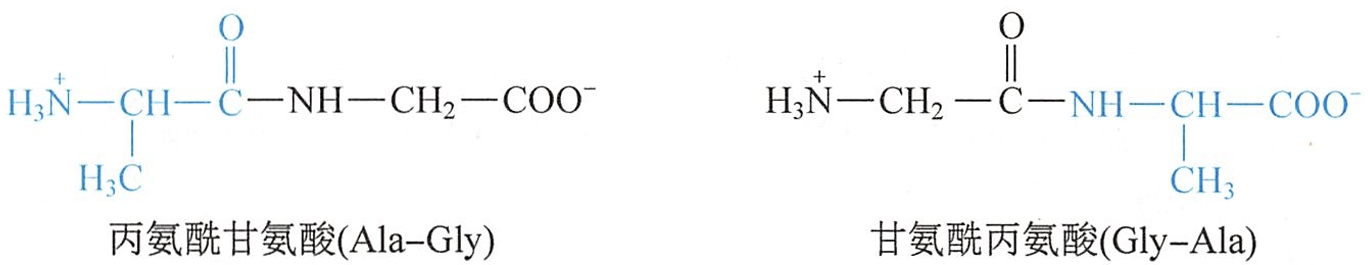
同理,由3种不同的氨基酸组成的三肽可有6种异构体;由4种不同的氨基酸组成的四肽可有24种异构体。由许多种氨基酸按不同的顺序排列,可形成大量的异构体,构成自然界中种类繁多的蛋白质和多肽。
二、肽单元
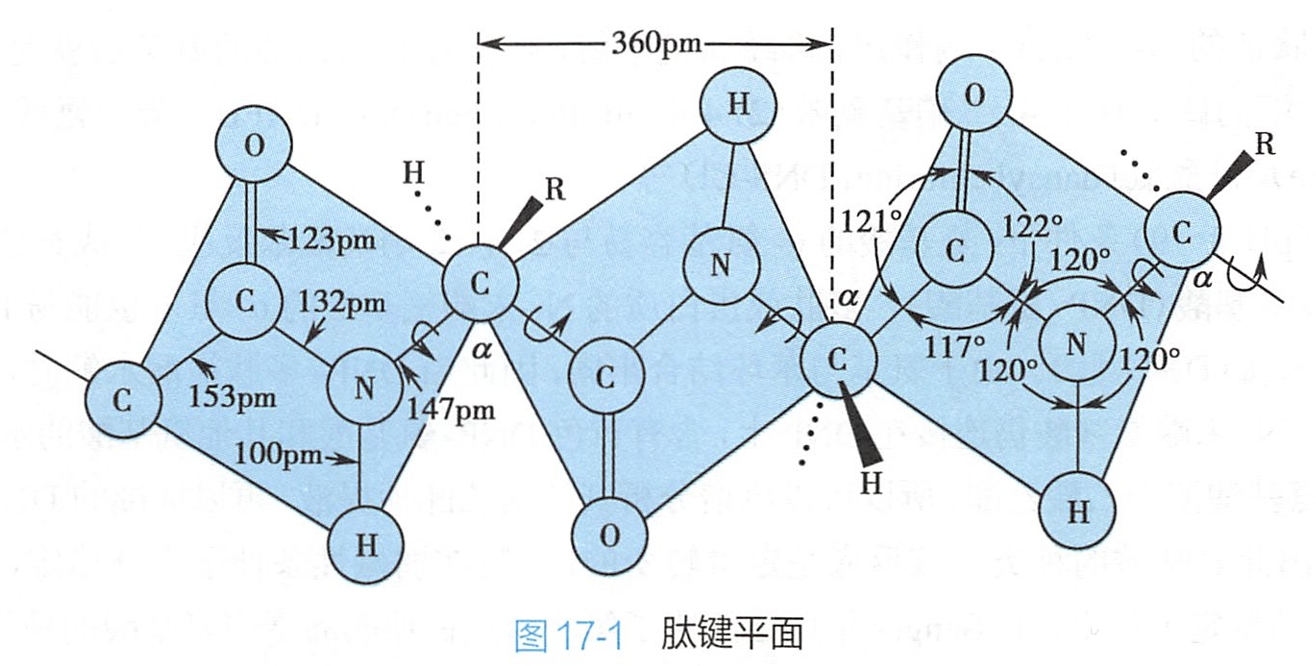
多肽分子中构成多肽链的基本化学键是肽键,肽键与相邻两个α-碳原子所组成的基团(-Cα-CO-NH-Cα-)称为肽单元。肽单元的空间结构具有以下4个显著的特征:
- 肽单元是平面结构,组成肽单元的6个原子位于同一平面内,这个平面称为肽键平面。
- 肽键具有局部双键性质,不能自由旋转。肽键中的C-N键长为132pm,比相邻的Cα-N单键(147pm)短,而较一般的C=N双键(127pm)长。这表明羰基的π电子发生离域现象,使肽键具有局部双键性质,因此C-N之间的旋转受到一定的阻碍。(补充:只有一个双键不用考虑太复杂。O有两对孤对电子,成键数1,是sp2杂化,有一个空p轨道;N有一对孤对电子,成键数3,因为C=O双键已经有两个p轨道形成π键,sp3杂化不如sp2稳定,可能是等性sp2杂化,2pz轨道上有一对电子以形成p-π共轭。)(离域π键即大π键、共轭π键,与定域π键相对,不过这里虽然离域,但不算大π键或者π-π共轭,应该属于p-π共轭。)
- 肽键呈反式构型。由于肽键不能自由旋转,与C-N键相连的O与H或两个C原子之间般呈较稳定的反式构型。
- 肽键平面中除C-N键不能旋转外,两侧的C-N和C-Cα键均为σ键,因而相邻的肽键平面可围绕Cα旋转,肽链的主链骨架也可视为由一系列通过Cα原子衔接的肽键平面所组成。肽键平面的旋转所产生的立体结构可呈现多种状态,从而导致蛋白质分子呈现各种不同的构象。
三、结构测定
测定多肽的结构不但要确定组成多肽的氨基酸种类和数目,还需测出这些氨基酸残基在肽链中的排列顺序。
多肽分子中氨基酸残基的排列顺序可采用末端残基分析法和部分水解等方法测定。
(一)氨基酸组成和含量分析
利用全自动氨基酸分析仪可测定多肽的组成。常将多肽用酸彻底水解成游离氨基酸的混合液,利用样品中各种氨基酸结构、酸碱性、极性及分子大小的不同,在阳离子交换柱上将其分离,采用不同pH值离子浓度的缓冲液将各氨基酸组分依次洗脱下来,再经柱后茚三酮衍生、光度法确定其组成和含量(图17-2)。
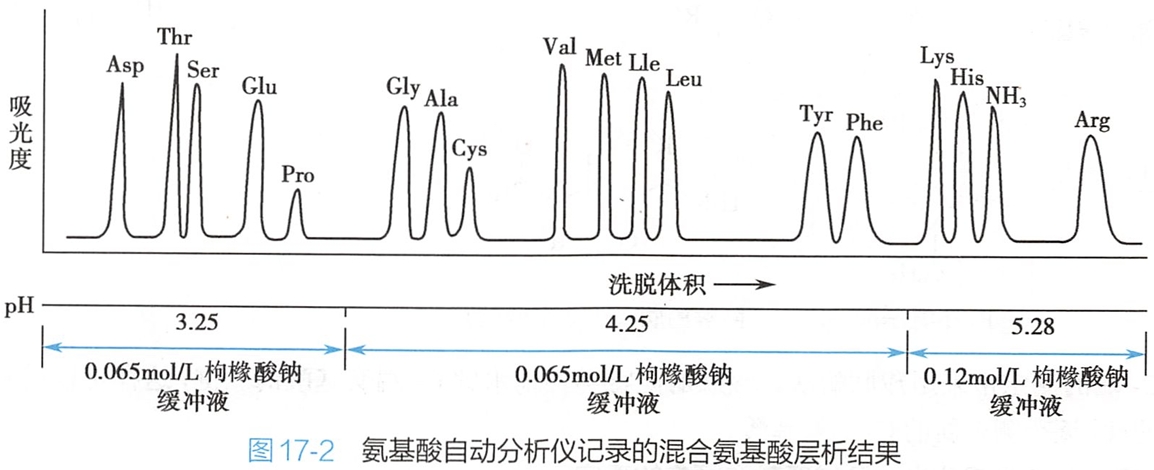
(二)肽末端氨基酸残基的分析
末端残基分析法即定性确定肽链中N-端和C-端的氨基酸。通常选择一种试剂作为标记化合物使之与肽链的N-端或C-端作用,再经肽链水解,则含有此标记物的氨基酸就是链端的氨基酸。
标记N-端的试剂有2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)、异硫氰酸苯酯(phenyl isothiocyanate)、丹酰氯(dansyl chloride,DNS-Cl)等。
弱碱性(pH8~9)条件下,氨基酸的α-氨基容易与2,4-二硝基氟苯反应,生成黄色的N-(2,4二硝基苯基)氨基酸(DNP-氨基酸)。多肽或蛋白质的N-末端氨基酸的α-氨基也能与DNFB反应,生成二硝基苯肽(DNP-肽)。
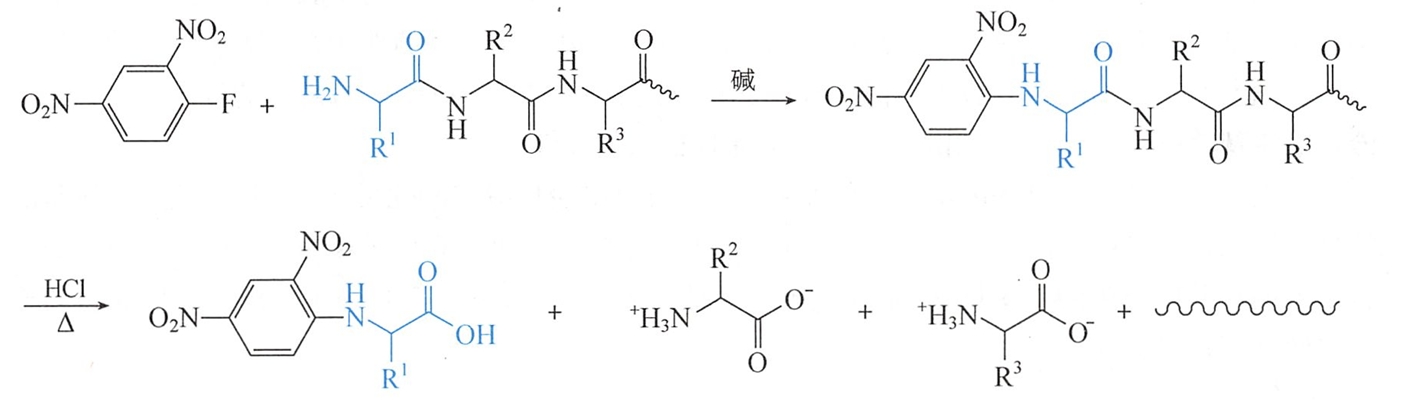
由于氨基与苯环结合牢固,因此当DNP-多肽被酸水解时,所有肽键均被水解,只有N-末端氨基酸仍连接在DNP上,含有黄色DNP-氨基酸和其他氨基酸的水解混合液中只有DNP-氨基酸溶于乙酸乙酯,所以可以色谱分析其乙酸乙酯抽提液,再以标准的DNP-氨基酸作为对照鉴定出此氨基酸的种类。
该反应是定量转变的,产物在弱碱性条件下十分稳定,常用在多肽 N-端氨基酸的鉴定工作上。该反应也称为桑格反应(Sanger reaction),2,4-二硝基氟苯被称为Sanger试剂。
异硫氰酸苯酯可与肽链的N-端氨基作用生成苯氨基硫甲酰基肽(PTC-肽),然后在有机溶液中与无水HCl作用,PTC-肽经关环、水解后能选择性地将N-端残基以苯乙内酰硫脲氨基酸(PTH-amino acid)的形式断裂下来,用层析法即可鉴定其为何种氨基酸衍生物。
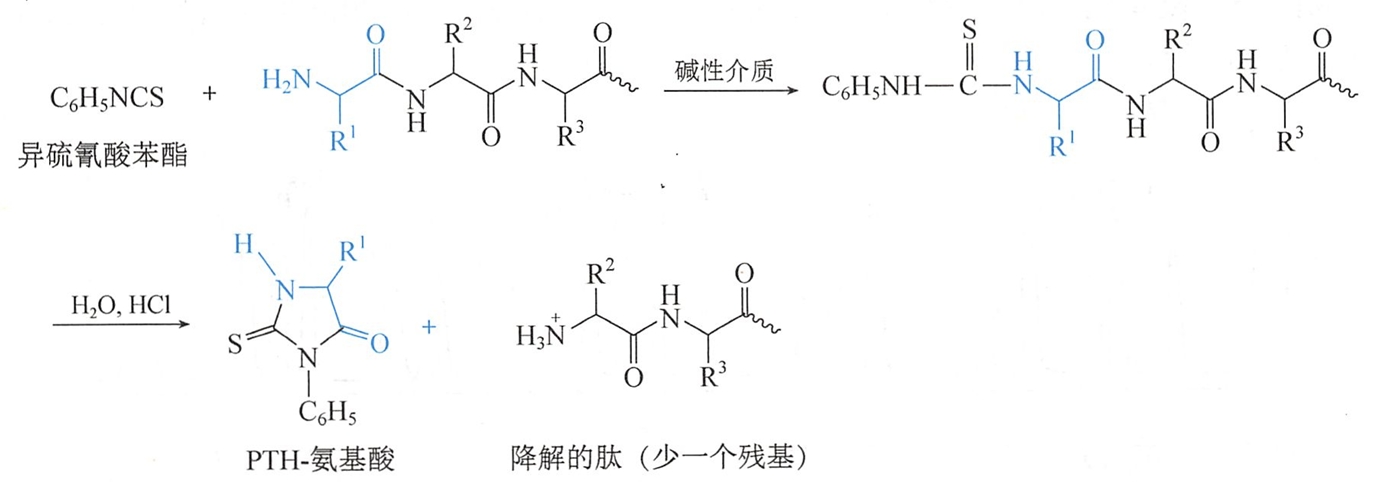
上述反应后仅失去1个N-端氨基酸残基的肽链可继续与异硫氰酸苯酯作用,如此逐个鉴定出氨基酸的排列顺序。此法称为埃德曼降解法(Edman degradation)。应用此原理设计的自动氨基酸顺序仪能测定60个氨基酸以下的多肽结构。
C-端的测定常采用羧肽酶法。羧肽酶能特异性地水解C-端氨基酸的肽键,这样可以反复用于缩短的肽,逐个测定新的C-端氨基酸。
(三)肽链的部分水解及其氨基酸顺序的确定
测定复杂多肽的结构,有时应用专一性地水解肽链的不同部位的蛋白酶进行多肽部分水解。如胰蛋白酶能专一性地水解Arg或Lys的羧基所形成的肽键,胰凝乳蛋白酶可水解芳香族氨基酸的羧基端肽键,从而获得各种水解片段。

通过分析各肽段中的氨基酸残基顺序,经过组合、排列对比,找出关键的“重叠顺序”,可推断各小肽片段在整个多肽链中的位置,最终获得完整肽链中氨基酸残基排列顺序。
(四)其他方法
通过DNA序列推演氨基酸顺序是目前常用的肽链顺序测定法。
近年来,随着波谱技术日新月异的发展,波谱技术在测定氨基酸、小肽和一些蛋白质等生命物质的研究中应用十分广泛。
采用电喷雾电离(electrospray ionization,ESI)质谱、基质辅助激光解吸电离(matrix-assisted laser desorption ionization,MALDI)质谱等新型的软电离生物质谱技术,可很快测定小肽的相对分子质量,甚至有些还可确定构成多肽的氨基酸类型和序列,因其具有所需样品少、方便、快速、可靠等诸多优点,是目前最有效的多肽和蛋白质序列分析方法之一。
采用高分辨核磁共振技术不仅能鉴定各种不同的氨基酸,而且还能测定多肽和相对分子质量小于20kD的一些蛋白质的二级、三级空间结构和溶液的构象。除了用作结构分析外,核磁共振的许多实验技术甚至还可以应用于生物体内的氨基酸、多肽的生物分子动态和生化反应动力学的研究。
补充:
质谱
分析分子、原子、或原子团的质量的,可以推测物质的组成,一般用于定性分析较多,也可定量。
化合物在高能电子束的轰击下形成带正电荷的分子离子和碎片离子,若按离子质荷比(相对质量与所带电荷之比)的差异进行分离测定,并记录,可以得到反映化合物结构信息的谱图即质谱(mass spectrum,MS)。相对于其他波谱方法,质谱突出的优,点是灵敏度高,样品的用量低。质谱是唯一可以确定被测物质分子式的技术。 20世纪80年代以来,有机质谱技术取得突破性进展,相继发明了电喷雾电离质谱(ESI-MS)、基质辅助激光解吸电离质谱(MALDI-MS)、快原子轰击质谱(FAB-MS)、离子喷雾电离质谱(ISI MS)、大气压电离质谱(API-MS)等软电离技术。借助于上述技术,生物大分子可转变成气相离子,从而使质谱分析可用于生物大分子的研究,并形成了生物质谱学这一新的学科。
是将不同质量的离子按质荷比的大小顺序收集和记录下来,得到质谱图。用质谱图进行定性、定量分析及结构分析。质谱分析法是物理分析法,早期主要用于相对原子质量的测定和某些复杂化合物的鉴定和结构分析。
使试样中各组分电离生成不同荷质比的离子,经加速电场的作用,形成离子束,进入质量分析器,利用电场和磁场使发生相反的速度色散——离子束中速度较慢的离子通过电场后偏转大,速度快的偏转小;在磁场中离子发生角速度矢量相反的偏转,即速度慢的离子依然偏转大,速度快的偏转小;当两个场的偏转作用彼此补偿时,它们的轨道便相交于一点。与此同时,在磁场中还能发生质量的分离,这样就使具有同一质荷比而速度不同的离子聚焦在同一点上,不同质荷比的离子聚焦在不同的点上,将它们分别聚焦而得到质谱图,从而确定其质量。
色谱
是一种兼顾分离与定量分析的手段,可分辨样品中的不同物质。
利用混合物中不同组分在两相之间进行不同分配的原理,使混合物分离,并进行定性和定量分析的方法。
当流动相中所携带的混合物流过固定相时,会和固定相发生作用。由于混合物中各组分在性质和结构的差异,与固定相之间作用力的大小也有差异。因此在同一推动力作用下,不同组分在固定相中的滞留时间有长有短,从而按先后不同的次序从固定相中流出。
按溶质在两相分离过程,可分为吸附色谱、分配色谱、离子色谱、体积排阻色谱、亲和色谱和生物色谱法。
光谱
定性分析,确定样品中主要基团,确定物质类别。从红外到X射线,都是光谱,其应用范围差别很大,是对分子或原子的光谱性质进行分析解析的。
由于每种原子都有自己的特征谱线,因此可以根据光谱来鉴别物质和确定它的化学组成和相对含量。
光谱分析时,可利用发射光谱,也可以利用吸收光谱。这种方法的优点是非常灵敏而且迅速。某种元素在物质中的含量达10皮克,就可以从光谱中发现它的特征谱线,因而能够把它检查出来。
光谱的分类:
- 按波长区域不同,光谱可分为红外光谱、可见光谱和紫外光谱。
- 按产生的本质不同,可分为原子光谱和分子光谱。
- 按产生的方式不同,可分为发射光谱、吸收光谱和散射光谱。
- 按光谱表现形态不同,可分为线光谱、带光谱和连续光谱。
波谱
通常指四大波谱:
- 核磁共振(NMR)
- 物质粒子的质量谱-质谱(MS)
- 振动光谱-红外/拉曼(IR/Raman)
- 电子跃迁-紫外(UV)。(应该也跟光谱有关吧) #?
四、生物活性肽
生物体内的某些重要活性肽(active peptide)含量较少,却起着重要的生理作用。某些细胞分化、肿瘤发生、生殖控制机制以及部分疾病的病因与治疗等涉及活性肽的结构和功能。
(一)内阿片肽
两种内源性阿片样活性物质——甲硫氨酸脑啡肽和亮氨酸脑啡肽,这两种脑啡肽(enkephaline)均为五肽,结构上它们仅C-端的1个氨基酸残基不同。

目前,已发现了十几种内源性阿片样肽,简称内阿片肽,如β-内啡肽、强啡肽A等,它们N-端的前4个氨基酸残基与脑啡肽相同(Tyr一Gly一Gly一Phe一)。
脑啡肽的第一位Tyr、第三位Gly和第四位Phe为活性基团,若这些位置上的氨基酸残基被其他氨基酸残基取代后即失去活性。
脑啡肽常易被氨肽酶和脑啡肽酶所降解,为了增加脑啡肽对酶解的稳定性,可采用人工合成脑啡肽类似物,常用D-型氨基酸(如D-Ala)取代第二位的Gly,成为有效的镇痛药物。
(二)谷胱甘肽
谷胱甘肽(glutathione)是一种广泛存在于动植物细胞中的重要三肽,它由L-谷氨酸、L-半胱氨酸和甘氨酸组成,即γ-Glu一Cys一Gly。它的结构特点是肽链的N-端上Glu通过它的γ-COO-(不是α-COO-)与Cys的α-NH3+脱水形成肽键。谷胱甘肽分子中因含有-SH,故称为还原型谷胱甘肽,简写成GSH。
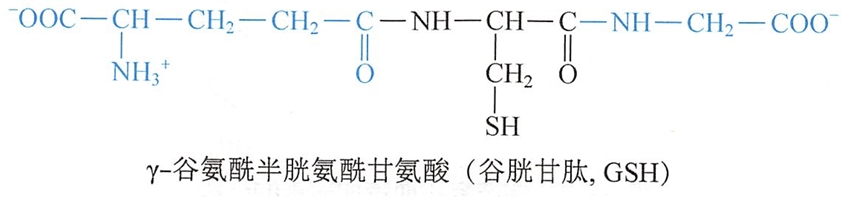
两分子的还原型谷胱甘肽的两个半胱氨酸的-SH在体内经酶催化氧化成二硫键-S-S-,形成氧化型谷胱甘肽(G-S-S-G)。
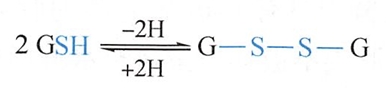
还原型谷胱甘肽在人类及其他哺乳类动物体内可保护细胞膜上含巯基的膜蛋白或含巯基的酶类免受氧化,具有生物还原剂的功能,从而维持细胞的完整性和可塑性。
(三)催产素和抗利尿激素
催产素(oxytocin)是一种垂体神经激素。 #生理
- 催产素能促进女性排卵,在分娩时引发子宫收缩,刺激乳汁分泌。
- 此外,它还能减少人体内肾上腺酮等压力激素的水平,以降低血压。临床上主要用于催生引产,产后止血和缩短第三产程。
- 此外,催产素具有广泛的生理功能,尤其是对中枢神经系统的作用。医学上用于引产、产后出血和子宫复原及催乳。
血管加压素(vasopressin),又称抗利尿激素,由下丘脑的视上核和室旁核的神经细胞分泌。
其主要生理作用是提高远曲小管和集合管对水的通透性,促进水的吸收,是尿液浓缩和稀释的关键性调节激素。医学上用于产后出血、消化道出血及尿崩等。
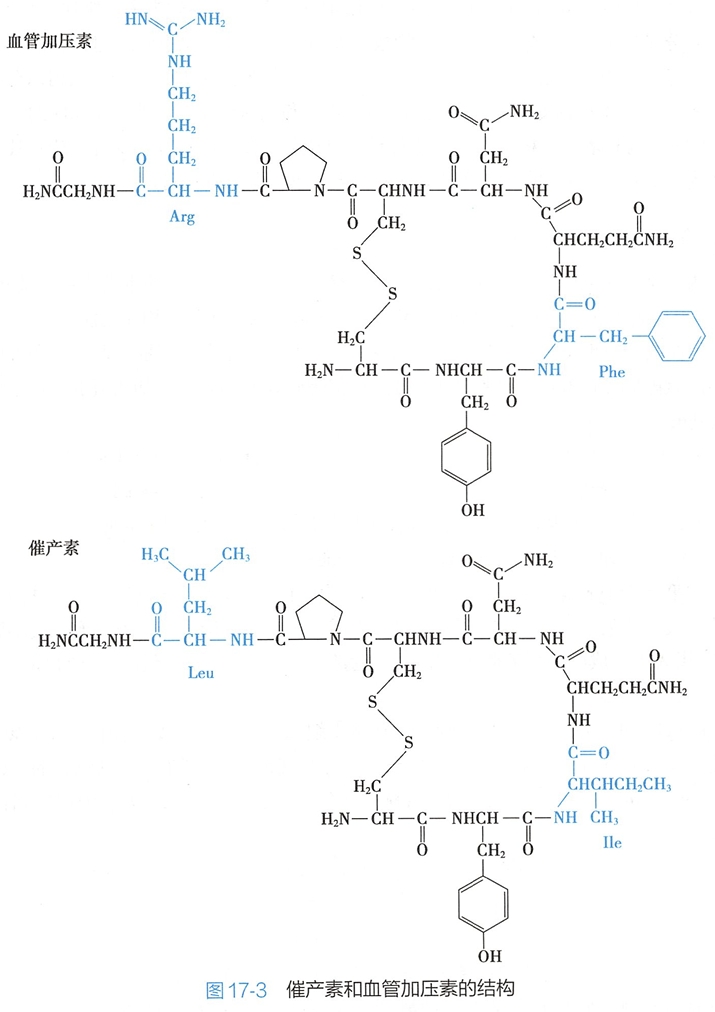
催产素和血管加压素均为九肽,仅有两个氨基酸单元不同,其结构如图17-3所示:
(四)非蛋白质来源多肽
在生物体内还存在非蛋白质来源多肽,组成这些肽的氨基酸有非蛋白质氨基酸,D-型氨基酸,形成的多肽除链状外尚有环状,如肌肽和短杆菌肽A。
由于体内蛋白酶通常是针对肽链中具有L-氨基酸的肽类进行水解,有其特异性,而非蛋白质肽类在结构上的变异保护了这些肽类不被体内蛋白酶水解,这些肽在体内有重要的生理意义,有的对动植物有毒,有的具有抗菌性和抗肿瘤等作用。
例如,环孢素A(cyclosporin A),是一种常用的免疫抑制剂,它是由11个氨基酸组成的环肽,其中含有一个D-丙氨酸。环孢素A通过和亲环素A(cyclophilin A,一种分子质量为20kD的伴侣蛋白质)形成复合物,从而抑制蛋白磷酸酯酶2B的活性,最终抑制T细胞受体信号通路而实现免疫抑制作用。
降钙素(calcitonin)是由32个氨基酸组成的多肽,可降低血钙,用于治疗骨质疏松症。